ကၽြန္ေတာ္ကေတာ့ ဓာတုေဗဒရဲ႕ အသက္လို႕ ဆိုခ်င္ပါတယ္။ တစ္ျခား မဟုတ္ပါဘူး ဓာတုေဗဒ သင္ယူသူတုိင္း ရင္းႏွီးၿပီးသားပါ။ ဓာတုေဗဒ ေလ့လာေနသူတိုင္း မရွိမျဖစ္၊ မသိမျဖစ္တဲ့ ဇယားေလးပါ။ ျမန္မာလို အက္တမ္ အလွည္႕က်ဇယား လို႕ေခၚတဲ့ Periodic Table ေလးပါပဲ။ ျဒပ္စင္ ( Elements ) ေတြကို ဂုဏ္သတၱိအရည္အေသြး တူရာအလုိက္ စုစည္း ထည္႕သြင္းထားျခင္းမွ်သာ။
 |
| Mendeleev |
Periodic Table ကိုတီထြင္ဖန္တီး ခဲ့သူကေတာ့ ရုရွားႏုိင္ငံသား ဓာတုေဗဒပညာရွင္ Mendeleev ျဖစ္ပါတယ္။ ၁၈၆၉ ခုႏွစ္တြင္ ထုိအခ်ိန္က ေတြ႕ရွိထားေသာ အက္တမ္ ၆၃ လံုးကို အက္တမ္အေလးခ်ိန္ Atomic Mass ကိုအေျခခံၿပီး၊ တူရာ ဂုဏ္သတၱိအလိုက္ အုပ္စုဖြဲ႕ကာ စနစ္တက် စီစဥ္ခဲ့ျခင္း ျဖစ္သည္။
Atom တြင္ electrons မ်ားေနရာယူပံုမွာ Nucleus ႏွင့္အနီးဆံုး ပတ္လမ္း ျဖစ္တဲ့ စြမ္းအင္နိမ့္ေသာ လမ္းေၾကာင္း မွစတင္ ၀င္ေရာက္သည္။ Nucleus ေ၀းေလေလ အီလက္ထရြန္ ပတ္လမ္း၏ စြမ္းအင္ ပမာဏ မ်ားေလေလ ျဖစ္သည္။
အက္တမ္ တစ္ခုအတြင္ ႏ်ဴကလိယက္စ္ကို လွည္႕ပတ္ေနေသာ အဓိက အီလက္ထရြန္ ပတ္လမ္း ( Main Shell ) မ်ားမွာ - K , L , M , N , O , .......စသည္ျဖင့္။
K=1 ( ပထမပတ္လမ္း )
L=2 ( ဒုတိယပတ္လမ္း )
M=3 ( တတိယပတ္လမ္း )
N=4 ( စတုတၳပတ္လမ္း )
Main Shell တြင္ထည္႕၀င္ႏုိင္ေသာ အီလက္ထရြန္ အေရအတြတ္ စုစုေပါင္း ေဖာ္ျမဴလာမွာ 2n2 ( two n square ) ျဖစ္သည္။ ထုိ႕ေၾကာင့္
K တြင္ အီလက္ထရြန္ ၂-လံုး
L တြင္ အီလက္ထရြန္ ၈-လံုး
M တြင္ အီလက္ထရြန္ ၁၈-လံုး
N တြင္ အီလက္ထရြန္ ၃၂-လံုး
L တြင္ အီလက္ထရြန္ ၈-လံုး
M တြင္ အီလက္ထရြန္ ၁၈-လံုး
N တြင္ အီလက္ထရြန္ ၃၂-လံုး
Main Shell မ်ားကို Sub-Shell မ်ားအျဖစ္ျပန္လည္ ခြဲျခားသည္။ ရွဲခြံခြဲမ်ားဟု ျမန္မာျပန္သည္။ ၄င္းတုိ႕မွာ s,p,d,f ျဖစ္သည္။ s - သည္ sharp၊ p - သည္ principle၊ d - သည္ diffuse၊ ျဖစ္ၿပီး f - သည္ Fundemendal ျဖစ္သည္။ အထက္ပါပံုတြင္ 1 သည္ ပထမပတ္လမ္း K၊ 2 သည္ ဒုတိယပတ္လမ္း L၊ 3 သည္ တတိယပတ္လမ္း M၊ 4 သည္ စတုတၳပတ္လမ္း N အသီးသီး ျဖစ္သည္။ s - sub-shell တြင္ အီလက္ထရြန္ ၂-လံုး၊ p- တြင္ ၆-လံုး၊ d - တြင္ ၁၀-လံုး ႏွင့္ f - တြင္ ၁၄ လံုးသာေနရာယူႏုိင္သည္။
အထက္တြင္ ဆိုခဲ့ၿပီးတုိင္း Periodic Table တြင္ Elements မ်ား စနစ္တက် ေနရာယူျခင္း ျဖစ္သည္။ Peridic Table တြင္ Group အုပ္စု VIII ခုရွိၿပီး၊ Periodic VII ခုရွိသည္။ Transition Elements မ်ားကို ျဖန္႕က်က္ထားပါက အုပ္စု ၁၈ ခုရွိသည္ဟု ထင္မွားႏုိင္သည္။ အျပင္ဘက္ဆံုး electons အေရအတြတ္အတုိင္း တူရာ အုပ္စုတြင္း သြင္းလုိက္ပါက Group 8 ခုသာရမည္။
Group I တြင္ ပါရွိေနေသာ ျဒပ္စင္မ်ား၏ အျပင္ဘက္ဆံုး ပတ္လမ္း ( Outermost Shells ) တြင္ အီလက္ထရြန္ တစ္လံုးသာ ရွိေနၾကသည္။ ထုိ႕အတူ Group II တြင္ ပါရွိေနေသာ ျဒပ္စင္မ်ား၏ အျပင္ဘက္ဆံုးပတ္လမ္းတြင္ အီလက္ထရြန္ ႏွစ္လံုး စသည္ျဖင့္၊ Group number VIII တြင္ ပါ၀င္ေနေသာ ျဒပ္စင္၏ အျပင္ဘက္ဆံုး ပတ္လမ္းတြင္ အီလက္ထရြန္ 8 လံုးအစီအစဥ္အတုိင္း ပါရွိသည္။
ေရျပင္ညီ အတိုင္းရွိေနေသာ Periodic ၏နားလည္ ပံုမွာလည္း၊ periodic I ဆိုလွ်င္ ၄င္း ျဒပ္စင္မ်ားသည္ အီလက္ထရြန္ ပတ္လမ္းတစ္ခုသာရွိသည္။ periodic II ဆိုလွ်င္ ၄င္း ျဒပ္စင္မ်ားသည္ အီလက္ထရြန္ ပတ္လမ္း ႏွစ္ခုရွိသည္။ periodic VII ဆိုလွ်င္ ၄င္း ျဒပ္စင္မ်ားသည္ အီလက္ထရြန္ ပတ္လမ္း ခုႏွစ္ခုအထိရွိသည္။
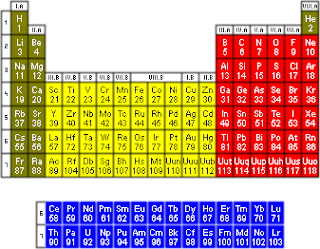
ဒီအေပၚက ဇယားေလးက Metals, Non-Metals နဲ႕ Metalloids ေတြကိုသိသာ ေစတယ္။
Metals - အနီေရာင္
Non-Metals - အ၀ါေရာင္
Metalloids - အစိမ္းေရာင္
Non-Metals - အ၀ါေရာင္
Metalloids - အစိမ္းေရာင္
ဒီဇယားေလးကေတာ့ s, p, d, f elements ( ျဒပ္စင္) မ်ားကို သိသာေစသည္။
s-Elements ေတြရဲ႕ အျပင္ဘက္ဆံုး electron က s-shell မွာရွိတယ္။
p-Elements ေတြရဲ႕ အျပင္ဘက္ဆံုး electron က p-shell မွာရွိတယ္။
d-Elements ေတြရဲ႕ အျပင္ဘက္ဆံုး electron က d-shell မွာရွိတယ္။
f-Elements ေတြရဲ႕ အျပင္ဘက္ဆံုး electron က f-shell မွာရွိတယ္။
s-Elements - အစိမ္းေရာင္
p-Elements - အနီေရာင္
d-Elements - အ၀ါေရာင္
f-Elements - အျပာေရာင္
s-Elements ေတြရဲ႕ အျပင္ဘက္ဆံုး electron က s-shell မွာရွိတယ္။
p-Elements ေတြရဲ႕ အျပင္ဘက္ဆံုး electron က p-shell မွာရွိတယ္။
d-Elements ေတြရဲ႕ အျပင္ဘက္ဆံုး electron က d-shell မွာရွိတယ္။
f-Elements ေတြရဲ႕ အျပင္ဘက္ဆံုး electron က f-shell မွာရွိတယ္။
s-Elements - အစိမ္းေရာင္
p-Elements - အနီေရာင္
d-Elements - အ၀ါေရာင္
f-Elements - အျပာေရာင္
ဒီဇယားေလးကေတာ့ ...
Alkali Metals
Alkaline Earth Metals
Other Metals
Non-Metals
Halogens
Inert Elements
Transition Elements
Rare Earth Metals
Actinide Series
Lanthanide series
တို႕ကို လြယ္ကူရွင္းလင္းစြာ ျမင္ႏုိင္သည္။
Alkaline Earth Metals
Other Metals
Non-Metals
Halogens
Inert Elements
Transition Elements
Rare Earth Metals
Actinide Series
Lanthanide series
တို႕ကို လြယ္ကူရွင္းလင္းစြာ ျမင္ႏုိင္သည္။










0 comments:
Post a Comment